| SPARC |
|---|
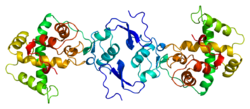 |
| Structure de la protéine SPARC. Basé sur l'identifiant PDB 1bmo. |
| Structures disponibles |
|---|
| PDB | Recherche d'orthologue: PDBe RCSB |
|---|
| Identifiants PDB |
|---|
1BMO, 1NUB, 1SRA, 2V53 |
|
|
| Identifiants |
|---|
| Aliases | SPARC, Ostéonectine, BM-40 |
|---|
| IDs externes | OMIM: 182120 MGI: 98373 HomoloGene: 31132 GeneCards: SPARC |
|---|
| Position du gène (Homme) |
|---|
 | | Chr. | Chromosome 5 humain[1] |
|---|
| | Locus | 5q33.1 | Début | 151,661,096 bp[1] |
|---|
| Fin | 151,686,975 bp[1] |
|---|
|
| Position du gène (Souris) |
|---|
 | | Chr. | Chromosome 11 (souris)[2] |
|---|
| | Locus | 11 B1.3|11 33.04 cM | Début | 55,285,326 bp[2] |
|---|
| Fin | 55,314,009 bp[2] |
|---|
|
| Expression génétique |
|---|
| Bgee | | Humain | Souris (orthologue) |
|---|
| Fortement exprimé dans | - tibia
- stromal cell of endometrium
- ligament alvéolo-dentaire
- vésicule biliaire
- Ganglion de Gasser
- bulbe olfactif
- ganglion sensitif d’un nerf spinal
- pleura viscéral
- muscle lisse
- aorte ascendante
|
| | Fortement exprimé dans | - calvaria
- corps du fémur
- aorte ascendante
- valve aortique
- cordon ombilical
- corpuscule carotidien
- molaire
- canal déférent
- skin of abdomen
- skin of back
|
| | Plus de données d'expression de référence |
|
|---|
| BioGPS | 
 | | Plus de données d'expression de référence |
|
|---|
|
| Gene Ontology |
|---|
| Fonction moléculaire | - Calcium liaison ionique
- liaison ion métal
- liaison protéique
- liaison de matrice extracellulaire
- collagen binding
- extracellular matrix structural constituent
| | Composant cellulaire | - cytoplasme
- platelet alpha granule
- endocytic vesicle lumen
- matrice nucléaire
- membrane plasmique
- intracellulaire
- membrane basale
- surface cellulaire
- platelet alpha granule membrane
- mitochondrie
- platelet alpha granule lumen
- noyau
- milieu extracellulaire
- vésicule
- région extracellulaire
- matrice extracellulaire
- synapse
- collagen-containing extracellular matrix
- glutamatergic synapse
| | Processus biologique | - response to cytokine
- response to cadmium ion
- ostéogenèse
- développement des poumons
- cellular response to growth factor stimulus
- response to peptide hormone
- platelet degranulation
- extracellular matrix organization
- response to L-ascorbic acid
- response to glucocorticoid
- cicatrisation
- endocytose à récepteur
- negative regulation of endothelial cell proliferation
- positive regulation of endothelial cell migration
- response to calcium ion
- response to gravity
- développement du cœur
- response to lipopolysaccharide
- response to lead ion
- regulation of cell population proliferation
- negative regulation of angiogenesis
- inner ear development
- regulation of cell morphogenesis
- response to cAMP
- response to ethanol
- développement osseux
- transduction de signal
- pigmentation
- regulation of synapse organization
| | Sources:Amigo / QuickGO |
|
| Orthologues |
|---|
| Espèces | Homme | Souris |
|---|
| Entrez | | |
|---|
| Ensembl | | |
|---|
| UniProt | | |
|---|
| RefSeq (mRNA) | |
|---|
NM_003118
NM_001309443
NM_001309444 |
| |
|---|
| RefSeq (protéine) | |
|---|
NP_001296372
NP_001296373
NP_003109 |
| |
|---|
| Localisation (UCSC) | Chr 5: 151.66 – 151.69 Mb | Chr 11: 55.29 – 55.31 Mb |
|---|
| Publication PubMed | [3] | [4] |
|---|
|
| Wikidata |
| Voir/Editer Humain | Voir/Editer Souris |
|
L’ostéonectine, ou BM-40 est une protéine d'adhérence à la matrice extra cellulaire. Son gène est appelé SPARC, « secreted protein, acidic, cysteine-rich », situé sur le chromosome 5 humain[5].
Structure
Son poids est de 34 Kdaltons. La protéine est formée de trois domaines[6].
Rôles
La protéine se fixe sur les cellules et sur la matrice extra-cellulaire. Elle joue ainsi un rôle dans la cohésion cellulaire ainsi que dans l'embryogenèse[7] et les processus de cicatrisation[8].
Elle permet également de moduler la réponses à plusieurs cytokines[7]. Elle inhibe en particulier l'action du facteur de croissance de l’endothélium vasculaire[9] ainsi que celle du PDGF (en) (« Platelet-derived growth factor »[10]). Elle diminue la prolifération cellulaire en stimulant la voie de la TGF bêta (en) (« transforming growth factor »[11]).
En médecine
Le taux de cette protéine est un marqueur de mauvais pronostic dans différents cancers[12]. Cela serait probablement dû plus à une réponse de l'organisme à un cancer agressif qu'à un effet délétère de cette protéine. En effet, elle peut jouer un rôle de limitation tumorale[13] et l'augmentation artificielle de son expression peut améliorer la réponse aux antimitotiques[14].
Dans certaines leucémies aiguës myéloblastiques (à cytogénétique normale), l'expression du SPARC semble corrélé avec une forme plus agressive et son inhibition en améliore la progression[15].
Notes et références
- ↑ a b et c GRCh38: Ensembl release 89: ENSG00000113140 - Ensembl, May 2017
- ↑ a b et c GRCm38: Ensembl release 89: ENSMUSG00000018593 - Ensembl, May 2017
- ↑ « Publications PubMed pour l'Homme », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- ↑ « Publications PubMed pour la Souris », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- ↑ (en) Swaroop A, Hogan BL, Francke U, « Molecular analysis of the cDNA for human SPARC/osteonectin/BM-40: sequence, expression, and localization of the gene to chromosome 5q31-q33 », Genomics. 1988;2:37–47.
- ↑ (en) Motamed K, « SPARC (osteonectin/BM-40) » Int J Biochem Cell Biol (en). 1999;31:1363–1366.
- ↑ a et b (en) Lane TF, Sage EH, « The biology of SPARC, a protein that modulates cell-matrix interactions » FASEB J. 1994;8:163–173.
- ↑ (en) Phan E, Ahluwalia A, Tarnawski AS, « Role of SPARC — matricellular protein in pathophysiology and tissue injury healing. Implications for gastritis and gastric ulcers » Med Sci Monit (en). 2007;13:RA25–RA30.
- ↑ (en) Kupprion C, Motamed K, Sage EH, « SPARC (BM-40, osteonectin) inhibits the mitogenic effect of vascular endothelial growth factor on microvascular endothelial cells » J Biol Chem. 1998;273:29635–29640.
- ↑ (en) Raines EW, Lane TF, Iruela-Arispe ML, Ross R, Sage EH, « The extracellular glycoprotein SPARC interacts with platelet-derived growth factor (PDGF)-AB and -BB and inhibits the binding of PDGF to its receptors » Proc Natl Acad Sci U S A. 1992;89:1281–1285.
- ↑ (en) Schiemann BJ, Neil JR, Schiemann WP, « SPARC inhibits epithelial cell proliferation in part through stimulation of the transforming growth factor-beta-signaling system » Mol Biol Cell (en). 2003;14:3977–3988.
- ↑ (en) Podhajcer OL, Benedetti LG, Girotti MR, Prada F, Salvatierra E, Llera AS, « The role of the matricellular protein SPARC in the dynamic interaction between the tumor and the host » Cancer Metastasis Rev (en). 2008;27:691–705.
- ↑ (en) Mok SC, Chan WY, Wong KK, Muto MG, Berkowitz RS, « SPARC, an extracellular matrix protein with tumor-suppressing activity in human ovarian epithelial cells » Oncogene. 1996;12:1895–1901.
- ↑ (en) Cheetham S, Tang MJ, Mesak F, Kennecke H, Owen D, Tai IT, « SPARC promoter hypermethylation in colorectal cancers can be reversed by 5-Aza-2′deoxycytidine to increase SPARC expression and improve therapy response » Br J Cancer (en). 2008;98:1810–1819.
- ↑ (en) Alachkar H, Santhanam R, Maharry K et al. « SPARC promotes leukemic cell growth and predicts acute myeloid leukemia outcome » J Clin Invest. 2014 DOI 10.1172/JCI70921.
 Portail de la médecine
Portail de la médecine  Portail de la biologie cellulaire et moléculaire
Portail de la biologie cellulaire et moléculaire

 Portail de la médecine
Portail de la médecine  Portail de la biologie cellulaire et moléculaire
Portail de la biologie cellulaire et moléculaire 















